2. 中国海洋大学 环境科学与工程学院, 山东 青岛 266100
各类海洋探测传感器需要在深远海海底长期工作,服务于海洋开发和国防需求。电源的持续供给是此类传感器长期工作的重要保障,现在常用的电源有高能锂电池、电缆,但在深远海条件下难以解决海底长期电源供给的问题,这已经成为限制海洋探测技术的关键制约因素之一。人们迫切需要一种在海底原位长期供电的新型电源。
海洋沉积物微生物燃料电池(marine sediment microbial fuel cells, MSMFCs)是一种从海底沉积物中获取电能的生物电化学系统,通常包括一个嵌入海底沉积物并通过微生物汲取电子的阳极,以及一个浸置在海水中能接受外电路电子的阴极[1],在阴极上溶解氧可以作为电子受体发生氧化还原反应生成水。
与传统微生物燃料电池(MFCs)相比,MSMFCs能够以海水与海底沉积物的界面代替昂贵的质子交换膜;海底沉积物中大量的电子供体能为MSMFCs的产能、供能提供天然条件[2];海水中的高离子电导率能够降低电池内阻[3],以上独特优势使得MSMFCs有望实现海底原位长期供电[4]。本课题组已经于2012年及2016年在胶州湾海底布放国际上最大的海泥电池装备,并成功驱动海洋传感器长期运行17个月以上,取得成功[5-6]。
目前,通过减小阴极与阳极之间距离从而有效降低能量损耗的方式成为提高MSMFCs产电能力的重要措施[7],两极之间距离的减少直接导致阴极与海底沉积物的距离越来越近。MSMFCs在海底长期运行过程中,海水中的阴极因为台风、洋流、底栖动物等因素扰动,可能被海底沉积物不同程度地掩埋。这可能造成阴极环境的热力学和动力学条件改变,影响电极电化学性能,进而影响产电性能[8]。迄今为止,较少见到海底沉积物掩埋程度对阴极性能及电池性能相关影响的研究报道。
本文在实验室模拟MSMFCs的阴极不同程度被掩埋在海底沉积物中,研究海泥掩埋程度与阴极电化学性能和电池产电性能之间的关系,总结出浅层掩埋对电极及电池各方面性能影响,为MSMFCs在海底长期应用和阴极结构设计奠定技术基础。
1 材料与方法 1.1 电极制备首先将碳毡切割成30 mm×30 mm若干方形,正方形碳毡依次经丙酮、乙醇溶液分别超声清洗30 min,超声清洗后样品用蒸馏水冲洗至无试剂残留并80℃烘干。之后沿着处理好的碳毡轮廓穿入钛丝(ϕ1 mm),以钛丝作为骨架支撑碳毡形状,制成MSMFCs的阴极碳毡如图 1a)所示。阳极材料由4个碳刷组成,用钛丝将其串联,其稳定性远大于阴极,可抵抗阴极变化引起的干扰。
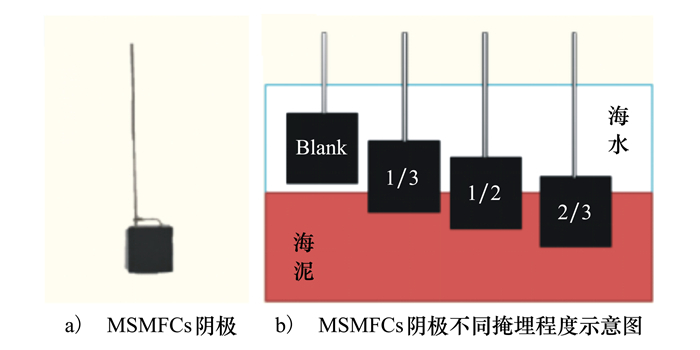
|
| 图 1 MSMFCs阴极 |
海底沉积物(海泥)、海水均取自胶州湾,首先将海泥在实验室中物理混合2 h,以确保沉积物成分均匀。然后将海泥按每组600 g分别放置于500 mL烧杯中,保持沉积物湿润培养15天,以模拟海底沉积物中微生物生存环境[9],MSMFCs阴极掩埋程度示意见图 1b)。最后将制备完成的阴极不同程度地掩埋在海底沉积物中,完成MSMFCs阴极环境的构建。按掩埋程度分别命名为:1/3组、1/2组和2/3组,此外空白对照组置于海水中,与沉积物无接触。待阴极掩埋完毕后,通过盐桥与稳定的阳极连接组成MSMFCs,以避免两极之间不同的距离差造成额外影响。向海水中泵入空气,维持溶解氧浓度在(5.18±0.29)mg/L之间,消除溶氧量对阴极造成的限制[10]。
1.3 电池性能测试采用电化学工作站(上海辰华CHI660E)测试阴极电化学性能,构建三电极体系,工作电极为碳毡阴极,对电极为铂片电极(30 mm×30 mm),本文中参比电极为饱和甘汞电极(SCE)。循环伏安测试:扫描区间-0.2~0.8 V,扫描速度为1 mV/s;塔菲尔测试:扫描范围开路电位±0.2 V,扫描速度为1 mV/s;电化学阻抗谱:频率10~20 kHz,振幅为5 mV。使用万用表(MY61,上海精密仪器科技有限公司)和电阻箱(ZX-21,上海精密仪器科技有限公司)测定电池性能;开路电势测量:使用SCE和万用表(量程0~2 V);功率测试:电压表量程0~2 V,电流表 0~2 mA,电阻箱范围:105~0.1 Ω;功率密度P根据P=IU/S计算,I为MSMFCs闭路电流,U为MSMFCs闭路电势,S为阴极面积。
2 结果与讨论 2.1 电化学性能分析 2.1.1 开路电势及稳定性分析图 2展示了不同掩埋程度的MSMFCs阴极开路电势(open circuit potential, OCP)随时间变化情况。最初各组开路电势分别为:空白组(170±10)mV、1/3组(238±10)mV、1/2组(57±10)mV和2/3组(-141±10)mV。阴极经过一段时间静置之后,OCP逐渐趋于稳定,空白组、1/3组和1/2组大约7天后OCP分别稳定在(313±10)mV、(303±10)mV和(285±10)mV,在稳定过程中,空白组和1/3组OCP出现多次波动之后上升至稳定值,1/2组OCP则急剧上升后渐渐平缓,最终降至稳定值,2/3组OCP在第6天降至-351 mV后,迅速上升至稳定电位。但2/3组所需的稳定时间相较其余组更多,其OCP在9天后稳定在(258±10)mV。阴极OCP共进行了为期24天的监测,各组OCP在达到稳定值之后,后续基本保持不变。

|
| 图 2 MSMFCs阴极开路电位 |
结果表明,MSMFCs阴极被沉积物掩埋能够引起开路电势和稳定时间的不同。在阴极被掩埋的第1天,各组OCP因受溶解氧浓度的影响而表现出明显差异,2/3组OCP相较空白组降低了311 mV。随着电极被沉积物掩埋时间的增长,被掩埋部分的电极受沉积物的影响也逐渐显示在电极的OCP上,2/3组OCP由于受到沉积物中一些生物和化学过程的影响,其电位逐步降低后又急剧上升[11]。各组OCP都趋于稳定后可知,电极掩埋程度的增加可导致阴极OCP降低,实验中电势由空白组的313 mV下降到2/3组的(258±10)mV。就阴极稳定时间而言,2/3组稳定所需时间为9天,多于其余组所需时间(7天),说明阴极掩埋程度越大,其电位达到稳定所需的时间越长。
2.1.2 循环伏安测试分析如图 3所示,随着阴极被掩埋程度不同,不仅阴极电容量产生了明显差异,且氧化峰和还原峰也发生了变化。空白组没有出现氧化峰,但1/3组和2/3组分别在0.275 V和0.252 V的位置出现了氧化峰,此外2/3组还在0.369 V的位置也出现了氧化峰。各组样品还原峰之间的差异更为显著,空白组只存在一个位于0.272 V的还原峰,而1/3组、1/2组以及2/3组都在0.5~0.6 V之间存在一个还原峰。不同掩埋程度的电极氧化还原峰的峰电势、峰电流详见表 1。如表所示,各组阴极电容分别为44 F/cm2(空白组)、34 F/cm2(1/3组)、38 F/cm2(1/2组)和32 F/cm2(2/3组)。其中空白组电容最大为44 F/cm2,2/3组电容最小为32 F/cm2,较空白组电容相差12 F/cm2。
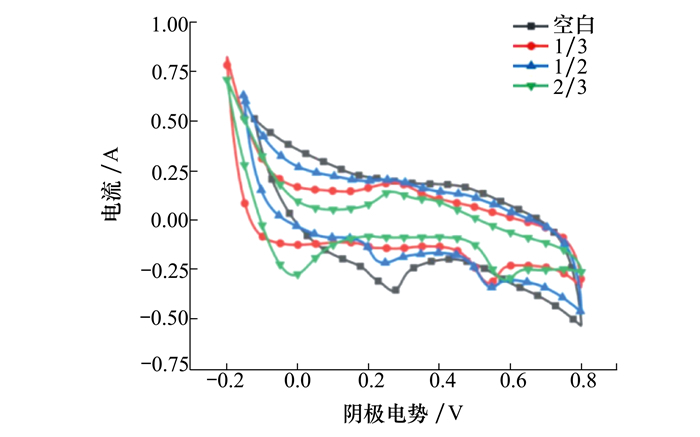
|
| 图 3 循环伏安曲线图 |
| 样品 | 氧化峰/V | 还原峰/V | 电容/(F·m-2) | ||
| 空白 | - | - | 0.272 | - | 44 |
| 1/3 | 0.275 | - | 0.539 | - | 34 |
| 1/2 | - | - | 0.242 | 0.545 | 38 |
| 2/3 | 0.252 | 0.369 | 0.014 | 0.579 | 32 |
空白组峰电势为0.272 V,其上发生的反应为:O2+2H2O+4e-→40H-,该反应是目前普遍认为最有利于MSMFCs提高电池性能的阴极反应。1/2组0.242 V的还原峰与空白组相近,可能发生了与空白组相同的反应。此外1/3组、1/2组以及2/3组都在0.5~0.6 V之间存在一个空白组所没有的还原峰,该峰明显是受到来自沉积物中物质的影响而产生的[12]。根据还原峰的位置,推断可能发生了如下反应:
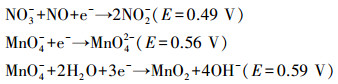
|
由各个阴极的Tafel曲线(见图 4),利用n=a+blg|i|可得各组电极交换电流密度(见表 2),其中交换电流密度最大表现为1.98×10-6 A/cm2(2/3组)。进一步经比值计算可得各组电极动力学相对活性(KA),如表 2所示。
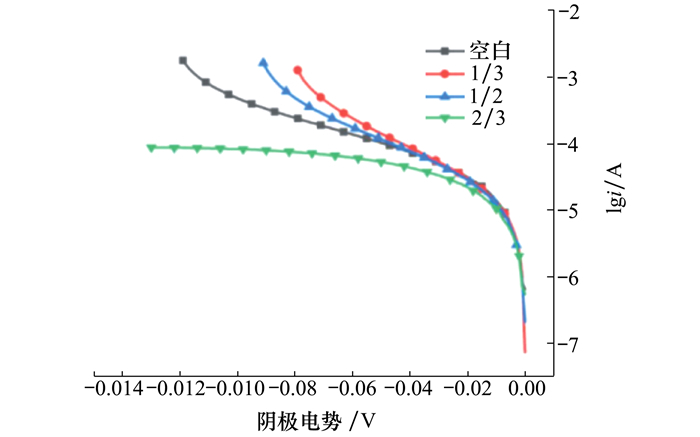
|
| 图 4 塔菲尔曲线图 |
| 样品 | 交换电流密度/(A·cm-2) | KA |
| 空白 | 1.23×10-6 | 1 |
| 1/3 | 8.91×10-8 | 0.07 |
| 1/2 | 4.67×10-7 | 0.37 |
| 2/3 | 1.98×10-6 | 1.61 |
KA最大的阴极(2/3组)是空白组的1.61倍。交换电流密度越大意味着电极的动力学活性越高,其表面的反应越容易发生。随着阴极被海底沉积物掩埋程度的变化,交换电流密度先降低后升高,表现为电极动力学活性先减弱后增强。并且在电极被掩埋程度较浅的时候,该变化趋势与电极的电容变化趋势相似。1/3组阴极交换电流密度相较于空白组降低是因为其表面原有的依靠氧气才能进行的反应被部分破坏,而位于被沉积物掩埋部分的电极表面发生的反应,不足以弥补氧气缺失造成的交换电流密度下降。随着被掩埋程度的增加,沉积物中的反应更加复杂、活跃,存在除氧气以外的其他物质作为电子受体参与反应,丰富了阴极表面电子的消耗途径,使电子传递加快,电极动力学活性增强,因此交换电流密度又逐渐增大[13]。
2.1.4 电化学阻抗分析各组阴极电化学阻抗谱如图 5和表 3所示,其中溶液电阻Rs最小为2.3 Ω(2/3组)。随着阴极被海底沉积物掩埋程度的增加,Rs先增大后减小,但是总体变化不明显。电荷转移电阻Rct最小为46.1 Ω(1/3组),其变化趋势为先减小后增大,2/3组的Rct增大到空白组2.33倍。

|
| 图 5 阴极电化学阻抗谱图 |
由比较可得,Rct的变化趋势与交换电流密度的变化趋势相同,这说明随着阴极被掩埋程度的增加,沉积物中的微生物发挥的作用愈加明显。1/2组和2/3组被沉积物覆盖的区域逐渐变大,故电极上富集的微生物逐渐变多。微生物数量的增多一方面增加了电子消耗量,使得电极交换电流密度变大;但同时另一方面导致生物膜的厚度增加,使得电荷转移受限,从而导致Rct增大[14]。
2.2 电池性能分析 2.2.1 极化曲线图 6为MSMFCs的极化曲线。随着电流增加(0~0.8 mA),阳极电势变化微弱((50±5)mV)。图 6b)阴极极化曲线图中,相同电流范围内不同阴极电势变化较小((700±50)mV)。虽然实验组与对照组中阴极所处环境不同导致其电化学活性和动力学活性存在区别,但其抗极化性能差别不大。由此可知阴极被海底沉积物掩埋的程度,对MSMFCs的抗极化性影响较小。
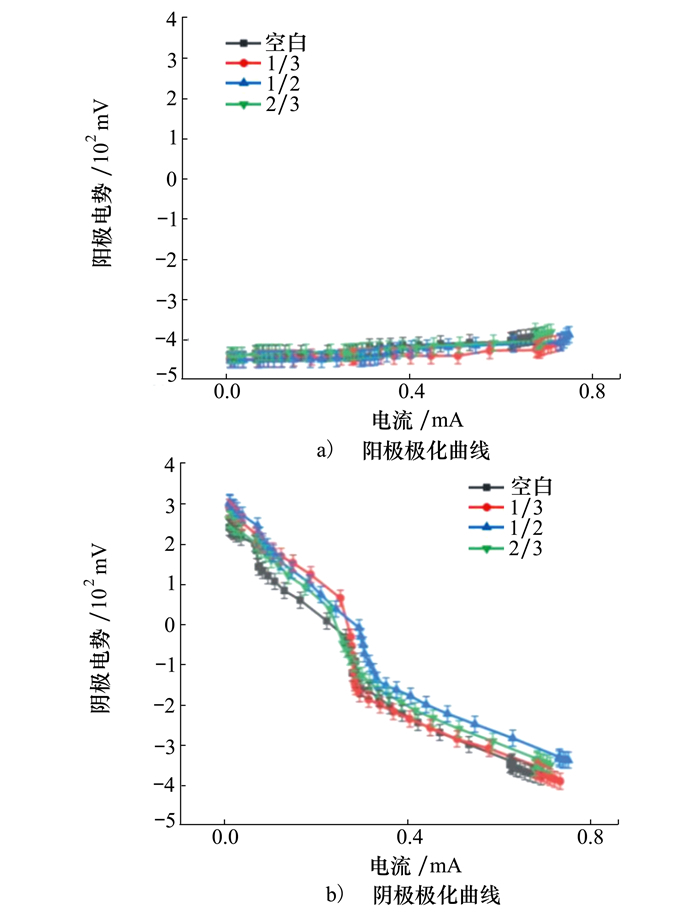
|
| 图 6 电极极化曲线图 |
各组MSMFCs最大功率密度分别见图 7、表 4。其中1/3组的最大输出功率密度最高,是空白组的1.21倍,1/2组、2/3组的最大输出功率密度分别是空白组1.17倍、1.01倍,均高于空白组。随着阴极被海底沉积物掩埋程度增加,MSMFCs最大输出功率密度先增大后减小。阴极掩埋各组电池输出功率均无降低,这说明阴极被海泥浅层掩埋并没有影响电池正常放电。
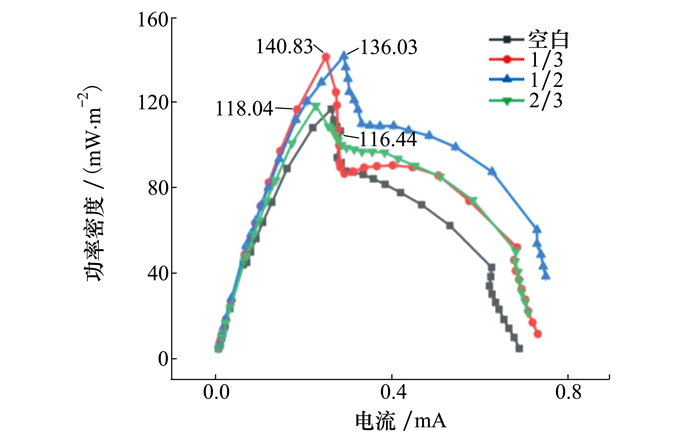
|
| 图 7 功率密度曲线图 |
| 样品 | 功率密度/(mW·m-2) | 相对倍数 |
| 空白 | 116.44 | 1.00 |
| 1/3 | 140.83 | 1.21 |
| 1/2 | 136.03 | 1.17 |
| 2/3 | 118.04 | 1.01 |
随着MSMFCs阴极被海底沉积物掩埋程度的增加,其开路电势不断降低,且稳定时间随之增长。这是由于阴极不仅依靠溶解氧消耗电子保持电位,还受沉积物中微生物的影响,利用硝酸盐等无机离子作为电子受体[15-16]。但以无机离子作为电子受体,与溶解氧相比其反应的氧化还原电位低,且反应速度慢。由CV曲线图可知,空白组的电极反应主要是氧气被还原,而实验组则发生了不同类型的反应。这可能是由硝酸盐、硫酸盐、金属(铁、锰等)氧化物等多种无机电子受体与微生物共同作用的结果。此类生物参与的氧化还原过程不如氧气还原这一单纯的化学过程进行的效率高,故电极电容下降[17]。
阴极的动力学活性与电荷转移电阻随其掩埋程度的变化趋势类似,都是先降低后增高。这一变化趋势受微生物数量的影响,随着阴极掩埋程度的增大,阴极表面附着的微生物数量不断增大[18]。阴极表面消耗的电子的量和生物膜的量增大,进而分别导致动力学活性增强以及电荷转移电阻增大。
本研究中电池的功率密度可以反映阴极综合性能的好坏。阴极被沉积物掩埋后,其电容、交换电流密度与阻抗均发生改变,即其在储能能力和电极表面反应发生难易程度等方面都发生了改变。但电池功率提升,说明电极的综合性能提升。
综上,MSMFCs阴极被海泥浅层覆盖初期,氧气还原仍能发挥一定作用;若阴极完全浸入氧缺乏的海泥中时,硝酸根等无机离子在生物参与条件下进行氧化还原反应,有可能会在动力学活性方面占主导地位。后续将在实海条件下,开展沉积物掩埋对阴极电化学性能和电池性能影响的研究,为电池长期运行和阴极设计提供技术支撑。
3 结论随着阴极被沉积物掩埋程度的增加,开路电位逐渐降低且所需稳定时间增加;阴极电容逐渐减小,最小电容降低至32 F/cm2(2/3组),是对照组的0.72倍;动力学活性先降后增,最大活性为对照组的1.61倍(2/3组);MSMFCs产电性能未受影响,最大功率密度达到了140.83 mW/m2(1/3组),是对照组的1.21倍。
本研究模拟了MSMFCs实际应用的海底环境,建立了阴极被掩埋程度与阴极电化学性能和动力学活性之间的联系,研究了海底沉积物覆盖程度对MSMFCs产电效果的影响,将为MSMFCs在海底长期工作条件下稳定产电及阴极结构设计提供技术支撑。
| [1] | REIMERS C E, TENDER L M, FERTIG S, et al. Harvesting energy from the marine sediment-water interface[J]. Environmental Science & Technology, 2001, 35(1): 192-195. |
| [2] | VANDIEKEN V, FINKE N, THAMDRUP B. Hydrogen, acetate, and lactate as electron donors for microbial manganese reduction in a manganese-rich coastal marine sediment[J]. FEMS Microbiology Ecology, 2014, 87(3): 733-745. DOI:10.1111/1574-6941.12259 |
| [3] | LOGAN B E, HAMELERS B, ROZENDAL R, et al. Microbial fuel cells: methodology and technology[J]. Environmental Science & Technology, 2006, 40(17): 5181-5192. |
| [4] | HE Z, SHAO H, ANGENENT L T. Increased power production from a sediment microbial fuel cell with a rotating cathode[J]. Biosensors and Bioelectronics, 2007, 22(12): 3252-3255. DOI:10.1016/j.bios.2007.01.010 |
| [5] |
付玉彬, 李建海, 赵仲凯, 等. 海底生物燃料电池作为电源驱动小型电子器件的应用研究[J]. 中国海洋大学学报, 2012, 42(6): 93-98.
FU Yubin, LI Jianhai, ZHAO Zhongkai, et al. Application research of marine sediment microbial fuel cell as power supply to drive small electronic equipments[J]. Periodical of Ocean University of China, 2012, 42(6): 93-98. (in Chinese) |
| [6] | ZHOU C, FU Y, ZHANG H, et al. Structure design and performance comparison of large-scale marine sediment microbial fuel cells in lab and real sea as power source to drive monitoring instruments for long-term work[J]. Ionics, 2018, 24(3): 797-805. DOI:10.1007/s11581-017-2251-2 |
| [7] |
谢焰, 周静, 沈杰, 等. 纤维层厚和叉指电极间距对MFC电输出性能的影响[J]. 硅酸盐通报, 2017, 36(12): 4193-4197.
XIE Yan, ZHOU Jing, SHEN Jie, et al. Influence of fiber thickness and spacing between interdigitated electrodes on MFC's electricity output performance[J]. Bulletin of the Chinese Ceramic Society, 2017, 36(12): 4193-4197. (in Chinese) |
| [8] | AN J, KIM B, NAM J, et al. Comparison in performance of sediment microbial fuel cells according to depth of embedded anode[J]. Bioresource Technology, 2013, 127: 138-142. DOI:10.1016/j.biortech.2012.09.095 |
| [9] | WANG Y, WEN Q, CHEN Y, et al. A novel polyaniline interlayer manganese dioxide composite anode for high-performance microbial fuel cell[J]. Journal of the Taiwan Institute of Chemical Engineers, 2017, 75: 112-118. DOI:10.1016/j.jtice.2017.03.006 |
| [10] | THOMAS Y R J, PICOT M, CARER A, et al. A single sediment-microbial fuel cell powering a wireless telecommunication system[J]. Journal of Power Sources, 2013, 241: 703-708. DOI:10.1016/j.jpowsour.2013.05.016 |
| [11] | YANG X, CHEN S. Microorganisms in sediment microbial fuel cells: ecological niche, microbial response, and environmental function[J]. Science of the Total Environment, 2020, 756(19): 144145. |
| [12] | LAM B R, BARR C R, ROWE A R, et al. Differences in applied redox potential on cathodes enrich for diverse electrochemically active microbial isolates from a marine sediment[J]. Frontiers in Microbiology, 2019, 10: 1979. DOI:10.3389/fmicb.2019.01979 |
| [13] | DELONG E F. Microbial life breathes deep[J]. Science, 2004, 306(5705): 2198-2200. DOI:10.1126/science.1107241 |
| [14] | REIMERS C E, GIRGUIS P, STECHER H A, et al. Microbial fuel cell energy from an ocean cold seep[J]. Geobiology, 2006, 4(2): 123-136. DOI:10.1111/j.1472-4669.2006.00071.x |
| [15] | ALGAR C K, HOWARD A, WARD C, et al. Sediment microbial fuel cells as a barrier to sulfide accumulation and their potential for sediment remediation beneath aquaculture pens[J]. Scientific Reports, 2020, 10(1): 1-12. DOI:10.1038/s41598-019-56847-4 |
| [16] | CLAUWAERT P, RABAEY K, AELTERMAN P, et al. Biological denitrification in microbial fuel cells[J]. Environmental Science & Technology, 2007, 41(9): 3354-3360. |
| [17] | XU H, WU J, QI L, et al. Preparation and microbial fuel cell application of sponge-structured hierarchical polyaniline-texture bioanode with an integration of electricity generation and energy storage[J]. Journal of Applied Electrochemistry, 2018, 48(11): 1285-1295. DOI:10.1007/s10800-018-1252-9 |
| [18] | LAM B R, ROWE A R, NEALSON K H. Variation in electrode redox potential selects for different microorganisms under cathodic current flow from electrodes in marine sediments[J]. Environmental Microbiology, 2018, 20(6): 2270-2287. DOI:10.1111/1462-2920.14275 |
2. School of Environment Science and Engineering, Ocean University of China, Qingdao 266100, China




