2. 空天微纳系统教育部重点实验室, 陕西 西安 710072;
3. 中国航空航天四川燃气轮机研究院, 四川 成都 610000;
4. 中航陕西航空电气有限公司, 陕西 西安 713107;
5. 深圳市迈瑞生物医疗电子有限公司, 广东 深圳 518057;
6. 西北工业大学 生命学院, 陕西 西安 710072;
7. 空间生物实验模拟技术国防重点学科实验室, 陕西 西安 710072
细胞图形化定位培养技术在细胞生物学、生物技术和组织工程等领域具有重要的应用价值[1],主要包括化学修饰法和物理结构法2大类[2-3],化学修饰法利用芯片表面修饰材料的化学性质差异(促进/抑制细胞粘附)实现细胞定位培养[4],通过在芯片表面涂覆或填充修饰材料获得特定的“亲细胞”图形区域和“斥细胞”图形区域。然而,当化学材料修饰的芯片浸泡在细胞培养基中时,会发生修饰材料剥离、降解甚至变性,从而降低了细胞定位的效果[5]。为了解决定位的稳定性问题,研究者提出利用物理结构来实现细胞定位培养[6]。然而,这些微结构本身并不具备“亲细胞”和“斥细胞”功能,对细胞的规约能力低于化学修饰法,在解决稳定性的同时降低了芯片的细胞定位效果。
研究表明,细胞外基质(extra cellular matrix,ECM)的机械性能,特别是刚度特性,可以介导细胞迁移、信号传导、增殖和分化[7-8]。通过调节基底的刚度,可以改变细胞在其表面的粘附性[3-9]。此外,细胞能够根据微柱阵列的刚度进行定向迁移[10]。基于此,本文提出一种微平台和微柱阵列交替排布构成的功能微拓扑结构,利用细胞在不同拓扑结构表面粘附的特异性构建“亲细胞”和“斥细胞”功能化表面,使细胞根据自身响应选择性定位生长于“亲细胞”的微平台表面,这种微拓扑结构芯片可以像化学修饰法一样严格地将细胞限制在特定位置,同时芯片采用具有良好生物相容性及高度化学稳定性的聚二甲基硅氧烷(PDMS)材料制备,可长期稳定存在于细胞培养液中,即在解决化学修饰法稳定性不足的同时保持了化学修饰法定位效果好的优势。
本文采用小鼠成骨细胞MC3T3-E1验证了芯片定位性能,重点研究了不同功能拓扑结构将细胞限制在微平台的能力,最终得到了定位效果良好的功能微拓扑结构细胞定位培养芯片。
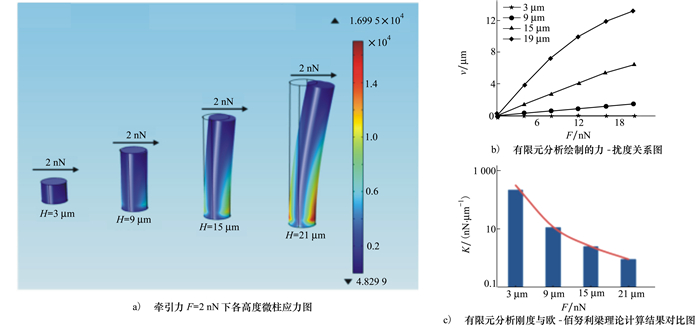
1 材料与方法 1.1 PDMS微柱有效刚度仿真分析当细胞接种于微柱阵列表面时,细胞在粘附的过程中其伪足会给微柱顶端以水平牵引力,微柱在该牵引力作用下会发生弯曲形变[11]。为表征所设计结构的有效刚度,本文采用COMSOL多物理场有限元分析软件(COMSOL V4.2, Comsol Inc., Burlington, MA)分析了不同高度PDMS微柱在相同水平牵引力F作用下的扰度,如图 1所示。PDMS微柱被建模为超弹性圆柱体,其杨氏模量为0.75 MPa,采用六面体网格单元划分,并赋予其底面固定边界条件。在所有微柱顶面节点上均匀施加水平牵引力F,计算微柱应力值,如图 1a)所示。各尺寸微柱顶端中心节点的扰度绘制曲线如图 1b)所示。根据纯弯曲的欧拉-伯努利梁理论近似计算微柱刚度K
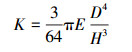
|
(1) |
|
| 图 1 微柱刚度有限元分析 |
式中,E, D和H分别为PDMS杨氏模量、微柱直径和微柱高度。由公式(1)可见,在不改变材料的整体机械性能或表面化学性质的情况下,可通过改变微柱高度H来调控微柱刚度K。在本项研究中,通过仿真分析确定微柱的刚度范围,以确保微柱阵列区域具有“斥细胞”功能。
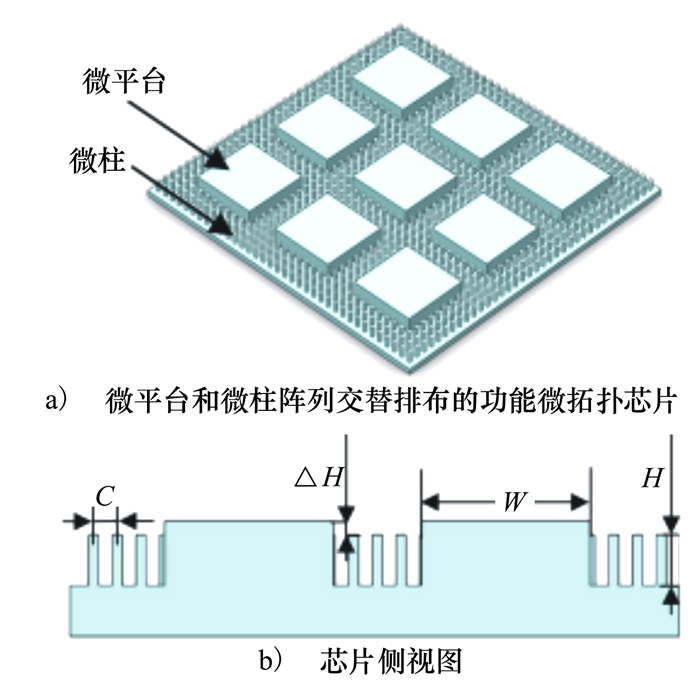
1.1 功能微拓扑结构设计功能微拓扑结构芯片由微平台和微柱阵列交替排布而成,如图 2所示。为了保证细胞有足够的生长空间,微平台边长W设计为50 μm×50 μm,微柱直径D设计为3 μm。根据课题组前期实验研究结果,微平台和微柱阵列的高度差ΔH设计为4 μm,微柱高度H分别为3, 9, 15和21 μm,并设计了2种不同的微柱中心间距C分别为7和13 μm。
|
| 图 2 芯片结构示意图 |
芯片采用具有良好生物相容性的PDMS材料制备。PDMS细胞定位培养芯片的制备包含两部分:利用MEMS技术制备硅模板和复制模塑技术制备PDMS芯片。硅模板采用传统的光刻技术、铝刻蚀和电感耦合等离子体刻蚀(inductively coupled plasma etch, ICP刻蚀)技术实现;再通过复制模塑技术将硅模板表面的微拓扑结构转移至PDMS材料表面,从而得到带有微拓扑结构的PDMS细胞定位培养芯片。硅模板制备工艺流程如图 3所示:首先在硅晶圆上溅射100 nm厚的Al膜作为第一个掩膜,并以2 500 r/min的转速在500 μm厚单面抛光的硅片上旋涂EPG533型正性光刻胶,然后使用第一层掩模版(包含微柱阵列图形)通过光刻将图形转移到光刻胶上;再通过铝刻蚀将图形转移到铝掩膜上,铝刻蚀液由磷酸(H3PO4):硝酸(HNO3):冰醋酸(CH3COOH):去离子水(H2O)按照体积比50:2:10:9的比例配成,图形转移成功后用丙酮溶液去除残留的光刻胶。这时,利用第二层掩膜版(包含微平台阵列图形)通过光刻胶旋涂及对准标记对准进行第二次紫外线曝光,显影后图形转移到光刻胶上;然后用铝刻蚀液刻蚀铝层;通过ICP刻蚀在硅片表面先刻蚀4 μm,再去除光刻胶;最后微平台阵列区域与微柱阵列区域同时刻蚀一定深度;C4F8表面钝化后,得到微平台和微柱阵列具有高度差的硅模板。

|
| 图 3 硅模板制备 |
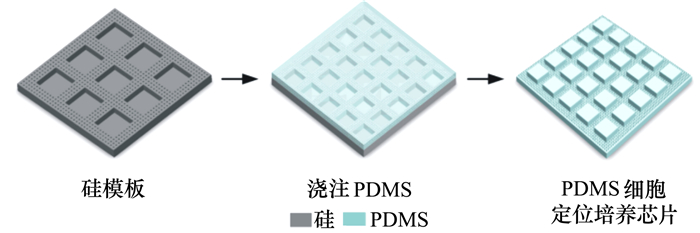
由于PDMS聚合物材料具有良好的生物相容性、合适的机械性能和模塑成型能力,在生物研究中具有广泛的应用前景[12]。本文涉及的PDMS芯片采用复制模塑技术制备,制备工艺流程如图 4所示:首先将PDMS(道康宁sygard 184)预聚物与固化剂按照10:1比例配置,或PDMS弹性体溶液,在真空室中脱气15 min,浇铸在硅模板上,在80℃下烘烤1 h固化,最后将固化好的PDMS从硅模板上剥离得到PDMS细胞定位培养芯片。再用O2等离子体(Harrick等离子体)处理1分钟得到亲水的PDMS细胞培养芯片,最后将PDMS细胞培养芯片小心地切成10 mm×10 mm的小块用于后期性能验证实验。
|
| 图 4 PDMS细胞定位培养芯片制备 |
小鼠成骨细胞MC3T3-E1(稳定表达GFP)购自中国医科院基础所细胞库,细胞复苏后在含10%胎牛血清(Hyclone),1%L-谷氨酰胺,1%100 ug/ml链霉素和100 ug/ml青霉素(Solarbio)的a-MEM细胞培养液(Hyclone)中培养,并在37℃含有5% CO2的培养箱中孵育。当细胞生长到约90%时,使用0.25%的胰蛋白酶消化液将其从培养瓶底部消化分离,再离心重悬,用相同的培养基稀释至所需浓度。在细胞接种之前,使用60Co(第四军医大学钴源室)对PDMS芯片进行灭菌处理,并用0.15 mg/mL的I型胶原蛋白(BD Falcon)对粘附于12孔培养板(Nunc)底部的PDMS芯片表面进行包被静置过夜,然后用无菌PBS冲洗2次,滴入约1.5 ml培养液,对芯片进行润湿,放置培养箱备用。最后,以每平方厘米1×104的浓度将MC3T3-E1细胞悬液悬滴到固定在12孔培养板中的PDMS芯片上,放置培养箱,根据实验需求,分别培养至24 h和48 h。
1.3.2 免疫染色在室温下,去除孔板里的细胞培养液,用37℃预热的1×PBS(pH7.4)润洗细胞2次;将粘附有细胞的PDMS芯片在4%的多聚甲醛中固定15 min,后用PBS清洗细胞3次,每次间隔5 min;再用0.1%Triton X-100穿孔,提高细胞通透性,室温5 min;用PBS冲洗3次,每次间隔5 min;1%BSA阻断20 min;用PBS冲洗3次,每次间隔10 min;添加染色剂鬼笔环肽-FITC(5 mg/ml, Sigma),0.5 ml/孔,室温孵育60 min(染细胞质/微丝,绿色);用PBS冲洗3次,每次间隔5 min;再用100 μl DAPI溶液(100 nm, Beyotime)对细胞核进行复染约30 s,用PBS清洗细胞3次,每次间隔5 min,获得肌动蛋白骨架和细胞核被染成绿色和蓝色的免疫染色细胞;最后滴加适量Fluoromount-GTM水溶性封片剂至PDMS芯片上,然后用指甲油永久封片,4℃避光保存待用。
1.3.3 图像处理与统计学分析采用激光扫描共聚焦显微镜(laser scanning confocal microscopy,LSCM,Leica sp)获取染色的MC3T3-E1细胞荧光图像,然后利用Image J软件(National Institutes of Health, USA)对图像进行处理分析。所得荧光图像数据利用IBM SPSS统计学分析软件分析处理,采用Student′s-t检验和方差分析,P < 0.05表示有显著性差异,P < 0.01表示有极显著性差异。数据结果为3次实验结果的平均值,每次实验3个样本。
2 结果与讨论 2.1 PDMS微柱刚度的表征图 1a)显示,微柱高度决定了微柱在受2 nN水平牵引力F作用下的弯曲程度。本文通过有限元分析仿真得到微柱受牵引力作用下的挠度大小,结合公式(1)计算得到微柱刚度K,如表 1所示。通过调节PDMS微柱的高度H(范围从3~21 μm),对应的微柱刚度范围为0.99~246.91 nN/μm。根据计算结果及Truong等人对附着在微柱上的细胞中肌动蛋白聚合影响的研究[13],我们认为高度大于9 μm的微柱没有足够的应力来支撑MC3T3-E1细胞纤维的张力,因而可以抑制细胞粘附。
| 微柱高度 H/μm |
微柱扰度 v/μm |
微柱刚度 K/(nN·μm-1) |
| 3 | 0.008 1 | 246.91 |
| 9 | 0.199 1 | 10.05 |
| 15 | 0.891 1 | 2.24 |
| 21 | 2.017 8 | 0.99 |
本文所设计的PDMS细胞定位培养芯片的制备主要包括硅模板制备和PDMS芯片制备2个工艺过程。现对比设计结构、硅模板结构和PDMS芯片,分析后微结构2个工艺参数变化。图 5和6分别为所制备的部分硅模板和PDMS芯片的扫描电子显微镜图像。可观察到不论是硅模板还是复形所得PDMS芯片,其表面微结构完整性良好,无缺损,且拓扑结构形状、大小一致性高。
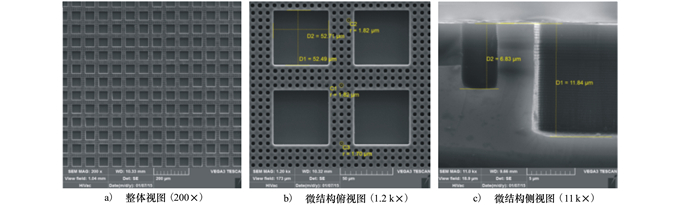
|
| 图 5 硅模板微结构扫描电镜图 |
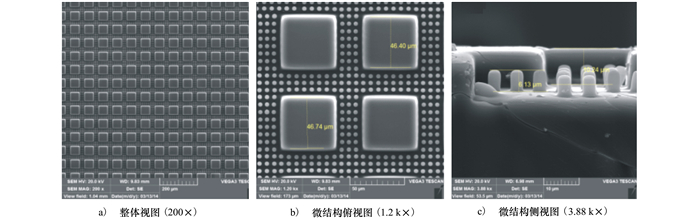
|
| 图 6 PDMS微结构扫描电镜图 |
有研究报道,表面形貌和结构机械性能可通过调节肌动蛋白细胞骨架来控制多种细胞过程[14]。本文中,通过MC3T3-E1细胞在不同微柱高度的芯片上的粘附形态,判断细胞是否呈现正常的生命形态以及所设计芯片结构对细胞的规约能力。通过图 7的荧光图像合成图可以看到,当细胞随机接种在不同高度的芯片上培养48 h后,生长在微平台上的MC3T3-E1细胞形态与微柱阵列区域上生长的细胞形态存在明显差异:生长在微柱阵列区域的细胞收缩成纺锤形,如图 7a)所示;而生长在微平台区域的细胞其骨架沿微平台边缘铺展充分,如图 7d)所示,表明细胞具备良好的生长形态和活力。
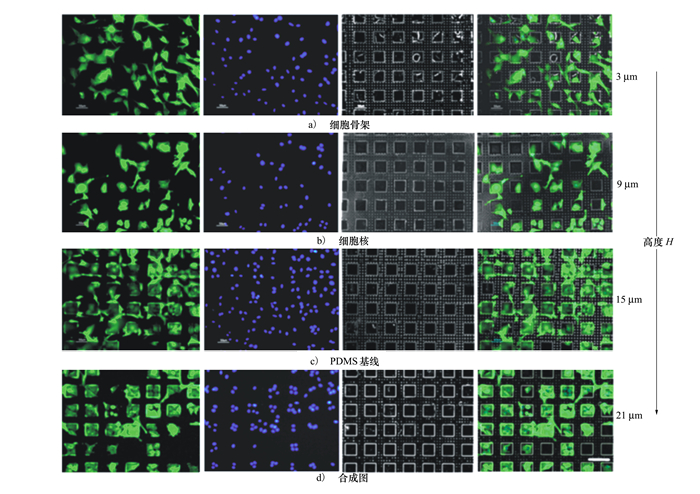
|
| 图 7 MC3T3-E1细胞在不同尺寸芯片上生长的免疫荧光图 |
此外,在微柱高度3 μm的芯片上,细胞随机粘附在整个芯片表面,微柱阵列没有呈现出显著的抑制细胞生长的特性(如图 7a)所示),随着微柱高度的增加,细胞粘附位点相应发生变化,逐渐从芯片的微柱阵列区域转向微平台区域,因此,生长在微柱阵列表面的细胞数量逐渐减少,而生长在平台表面的细胞数量逐渐增多(如图 7a)至7d)所示)。特别地,当微柱高度达到21 μm时,芯片基底结构的调控使得MC3T3-E1细胞的空间分布更加规律,微柱阵列区域极少有细胞粘附,而在微平台表面即使多个细胞粘附于同一平台上,各个细胞骨架铺满整个微平台表面也不会铺展到微平台之外的微柱阵列区域(如图 7d)所示),表明此时微柱阵列对于MC3T3-E1细胞粘附具有显著的抑制作用。由表 1可知,当微柱高度H从3增加到21 μm时,刚度K从246.91下降到0.99 nN/μm,而MC3T3-E1细胞作为生长在骨表面的成骨细胞更倾向于生长在较硬的芯片表面,因此,从细胞形态学角度我们可以看到,当微柱高度H=21 μm(刚度为0.99 nN/μm)时不能满足MC3T3-E1细胞生长所需刚度,从而起到抑制MC3T3-E1细胞粘附的作用。
2.3.2 细胞定位定量分析为了更好地评价不同结构参数芯片的细胞定位效果,我们引入了细胞定位率的概念。所谓细胞定位率,是指使用倒置显微镜或荧光显微镜观察结果芯片时,在所观察视野范围内,生长在微平台阵列区域的细胞数量与视野范围内细胞总数的百分比,见下式:

|
(2) |
本文研究了MC3T3-E1细胞在不同微柱高度的PDMS芯片上孵育48 h的粘附情形,如图 8所示。图 9a)至9b)定量比较了芯片不同微柱高度对细胞的规约能力,我们发现芯片上的细胞粘附位点受到微柱高度的有效调控。微平台的细胞定位率随着微柱高度的增加而增加,21 μm高的微柱可显著抑制细胞粘附。研究发现,微柱中心距离对调节细胞粘附位点的作用不显著,但在微柱高度为21 μm的芯片上,微柱中心间距为13 μm的微柱阵列较7 μm的微柱阵列对细胞的抑制作用更强。

|
| 图 8 48 h后,MC3T3-E1细胞粘附情况 |
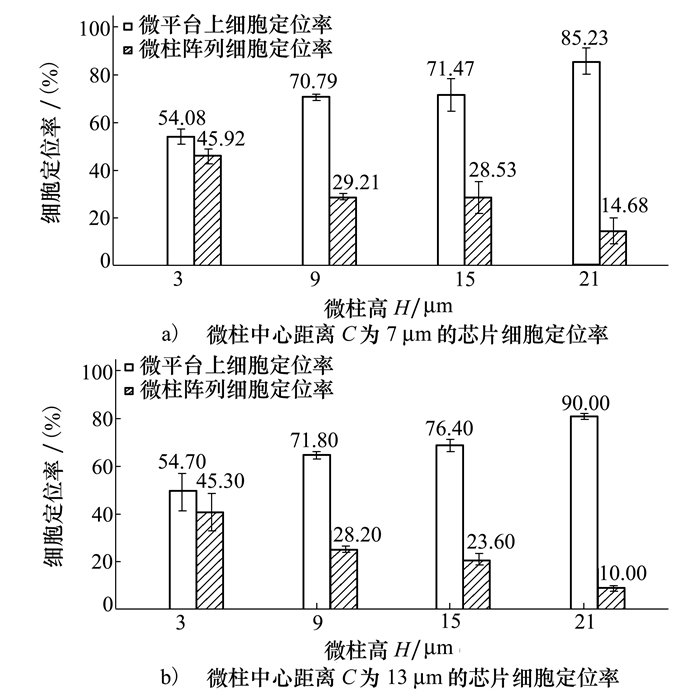
|
| 图 9 不同尺寸芯片细胞定位率定量分析结果 |
MC3T3-E1细胞粘附的显著差异表明微平台提供了较好的表面粘附特性,而微柱则随着高度的增加和刚度的降低而抑制细胞粘附。由上述分析可知,实现MC3T3-E1细胞定位生长的最佳PDMS芯片结构为微柱直径D=3 μm、微柱高H=21 μm、微柱中心距C=13 μm。该芯片结构可以将细胞高度规约在微平台区域,细胞定位率为90%,可以满足长期细胞定位培养的需求。
3 结论细胞在芯片上的定位生长受到芯片表面细胞粘附特异性的调控。本论文研究提出利用功能拓扑结构构建具有细胞粘附特异性的“亲细胞”和“斥细胞”功能性表面,通过改变微柱阵列刚度达到抑制细胞粘附生长的目的,从而实现细胞定位培养。微柱高度的变化导致细胞粘附位点的切换,对于MC3T3-E1细胞而言,随着高度的增加,细胞的粘附位点从微柱阵列区域迁移到微平台区域,从而将细胞规约在平台表面,实现细胞的定位培养。在细胞培养基中,微拓扑结构保持完整,满足稳定培养的条件。当微柱直径为3 μm、高度为21 μm、中心距离为13 μm、微平台边长为50 μm、高25 μm时,细胞铺展状态良好,胞体沿着微平台表面排列更规律,定位效果良好。即使多个细胞定位于同一微平台上,也不会扩散到微平台之外的微柱阵列区域,表明所设计的微柱阵列结构对MC3T3-E1细胞具有很强的规约能力。本文所设计制备的PDMS芯片具备化学修饰法对细胞规约能力强、定位效果好的优点,而芯片结构和材料的稳定性使其兼备物理结构法稳定性好的优点,同时芯片制备简单,可复现性高,有望为细胞-细胞、细胞-材料间相互作用、干细胞分化、基于细胞的生物传感器及单细胞研究等领域提供有效的分析工具。该芯片定位原理具有普遍适用性,研究者可根据不同细胞的粘附特性设计芯片结构尺寸,实现细胞的定位培养。
| [1] | ZHOU X, LI J, SUN H, et al. Controlled Cell Patterning on Bioactive Surfaces with Special Wettability[J]. Journal of Bionic Engineering, 2017, 14(3): 440-447. DOI:10.1016/S1672-6529(16)60409-2 |
| [2] | GUVEN S, CHEN P, INCI F, et al. Multiscale Assembly for Tissue Engineering and Regenerative Medicine[J]. Trends in Biotechnology, 2015, 33(5): 269-279. DOI:10.1016/j.tibtech.2015.02.003 |
| [3] | FU Jianping, WANG Yangkao, CHEN Christopher, et al. Mechanical Regulation of Cell Function with Geometrically Modulated Elastomeric Substrates[J]. Nature Methods, 2010, 7(9): 733-736. DOI:10.1038/nmeth.1487 |
| [4] | CHOI J S, KIM D H, SEO T S. Facile Endothelial Cell Micropatterning Induced by Reactive Oxygen Species on Polydimethylsiloxane Substrates[J]. Biomaterials, 2016, 84: 315-322. DOI:10.1016/j.biomaterials.2016.01.041 |
| [5] | JEON H J, SIMON C G, KIM G H. A Mini-Review:Cell Response to Microscale, Nanoscale, and Hierarchical Patterning of Surface Structure[J]. Journal of Biomedical Materials Research Part B:Applied Biomaterials, 2014, 102(7): 1580-1594. DOI:10.1002/jbm.b.33158 |
| [6] | YIANNAKOU C, SIMITZI C, MANOUSAKI A, et al. Cell Patterning via Laser Micro/Nano Structured Silicon Surfaces[J]. Biofabrication, 2017, 9(2): 1-8. |
| [7] | HAN Fengxuan, ZHU Caihong, GUO Qianping, et al. Cellular Modulation by the Elasticity of Biomaterials[J]. Journal of Materials Chemistry, 2016(4): 9-26. |
| [8] | Doyle, Andrew D, Yamada, Kenneth M. Mechanosensing via Cell-Matrix Adhesions in 3D Microenvironments[J]. Experimental Cell Research, 2016, 343(1): 60-66. DOI:10.1016/j.yexcr.2015.10.033 |
| [9] | MAURIZIO V, PAOLO N. Controlling Cell Functions and Fate with Surfaces and Hydrogels:the Role of Material Features in Cell Adhesion and Signal Transduction[J]. Gels, 2016, 2(1): 12. |
| [10] | SONG J, SHAWKY J H, KIM Y T, et al. Controlled Surface Topography Regulates Collective 3D Migration by Epithelial-Mesenchymal Composite Embryonic Tissues[J]. Biomaterials, 2015, 58: 1-9. DOI:10.1016/j.biomaterials.2015.04.021 |
| [11] | HUI J, PANG S W. Dynamic Tracking of Osteoblastic Cell Traction Force during Guided Migration[J]. Cellular and Molecular Bioengineering, 2017, 11(1): 11-23. |
| [12] | GUTEKUNST S B, CARSTEN G, ALEXANDER K, et al. Influence of the PDMS Substrate Stiffness on the Adhesion of, Acanthamoeba Castellanii[J]. Beilstein Journal of Nanotechnology, 2014, 5: 1393-1398. DOI:10.3762/bjnano.5.152 |
| [13] | TRUONG D T, BAHLS C, NEBE B, et al. An Implementation for the Simulation of Cells on Micro-Post Arrays[C]//2016 38th Annual International Conference of the IEEE Engineering in Medicine and Biology Society, 2016: 6138-6141 |
| [14] | OKEYO K O, MIYOSHI H, ADACHI T. Design Concept of Topographical and Mechanical Properties of Synthetic Extracellular Matrix to Control Cell Functions and Fates Through Actin Cytoskeletal Modulation[M]. Tokyo: Springer Japan, 2015: 159-189. |
2. Key Laboratory of Micro/Nano Systems for Aerospace, Ministry of Education, Northwestern Polytechnical University, Xi'an 710072, China;
3. China Hangfa Sichuan Gas Turbine Research Institute, Chengdu 610000, China;
4. AVIC Shaanxi Aero Electric Co Ltd, Xi'an 713107, China;
5. Shenzhen Mindray Bio-medical Electronics Co Ltd, Shenzhen 518057, China;
6. School of Life Sciences, Northwestern Polytechnical University, Xi'an 710072, China;
7. Key Laboratory of Space Bioscience and Biotechnology, Institute of Special Environmental Biophysics, Northwestern Polytechnical University, Xi'an 710072, China


